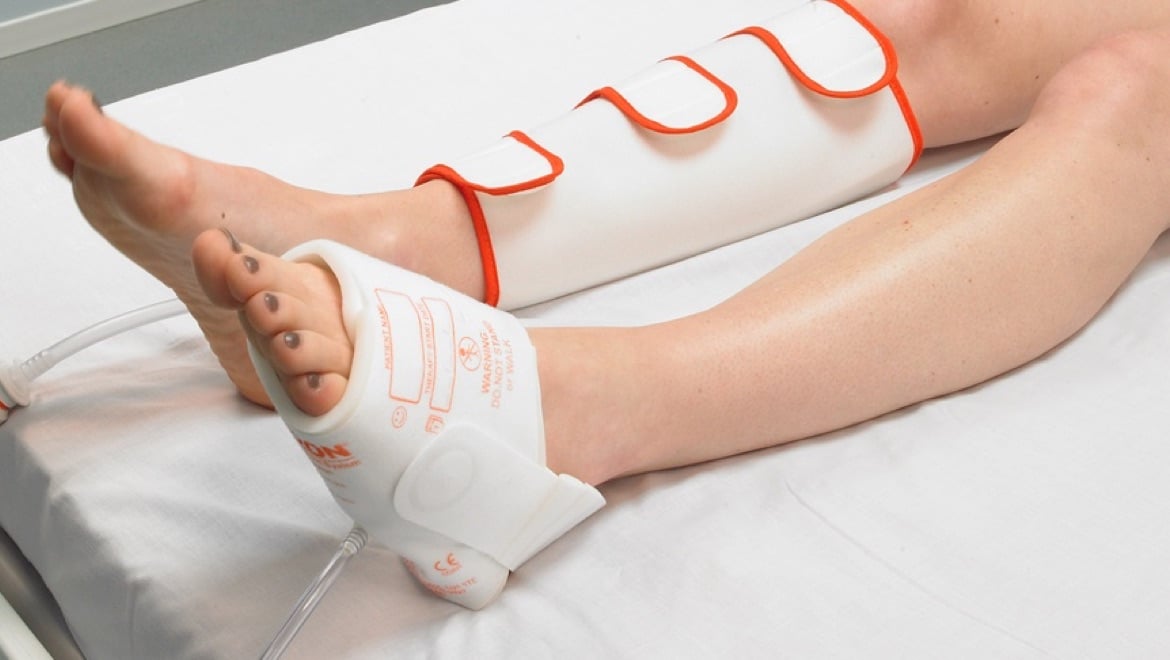
Die Bedeutung der Kompressionstherapie bei der VTE-Prophylaxe verstehen
Wenn wir eine kleine Wunde bekommen, loben wir oft die Gerinnungsfähigkeit unseres Blutes, um die Wunde zu schützen und weiteren Blutverlust zu verhindern. Wenn das Blut jedoch am falschen Ort zur falschen Zeit zu gerinnen beginnt, können die Folgen lebensverändernd und sogar tödlich sein. Jedes Jahr verursachen Blutgerinnsel in den tiefen Venen erhebliches Leid für Millionen von Menschen. In diesem Artikel befassen wir uns eingehend mit Blutgerinnseln, ihren Ursachen und damit, wie das Aktive Kompressionssystem Flowtron dazu beitragen kann, diese Erkrankung zu verhindern.
„Weltweit treten jährlich etwa zehn Millionen Fälle venöser Thromboembolie (VTE) auf. VTE ist eine lebensbedrohliche Erkrankung, die eine beträchtliche Kostenbelastung für Akutpflegeeinrichtungen und das Gesundheitssystem darstellen kann“, erklärt Henrik Runnerström, Global Director in Product Category Management, VTE-Prophylaxe bei Arjo.
Etwa 30 Prozent der Patienten sterben innerhalb von 30 Tagen nach dem Auftreten einer VTE, wobei 25 Prozent der unerwarteten stationären Todesfälle bei der Autopsie mit einer Lungenembolie diagnostiziert werden.1
Etwa ein Drittel aller Patienten mit einer tiefen Venenthrombose (TVT) entwickelt ein postthrombotisches Syndrom, das Leiden, Schwellungen und Schmerzen verursacht.1 Bei 25 Prozent dieser Patienten2 ist die daraus resultierende chronische Ulzeration mit erheblichen laufenden Behandlungskosten verbunden3.
Henrik Runnerström sagt weiter: „Neben dem gesamten menschlichen Leid führt die hohe Anzahl an VTE-Fällen zu einer erheblichen Kostenbelastung für Akutpflegeeinrichtungen und das Gesundheitssystem.“
Was ist VTE?
Venöse Thromboembolie (VTE) ist der Sammelbegriff, der die tiefe Venenthrombose (TVT) und auch die Lungenembolie (LE) umfasst. TVT liegt vor, wenn sich ein Blutgerinnsel in einer tiefen Vene, am häufigsten im Bein, bildet, während eine LE auftreten kann, wenn sich das Gerinnsel löst und in die Lunge gelangt, wodurch die Blutversorgung teilweise oder vollständig blockiert wird.
Eine Lungenembolie ist eine potenziell tödliche Erkrankung.4 Während eine frühe Diagnose und Behandlung von TVT zur Genesung führen kann, können langfristige Komplikationen zu lebenslanger Behandlung und Leiden führen.
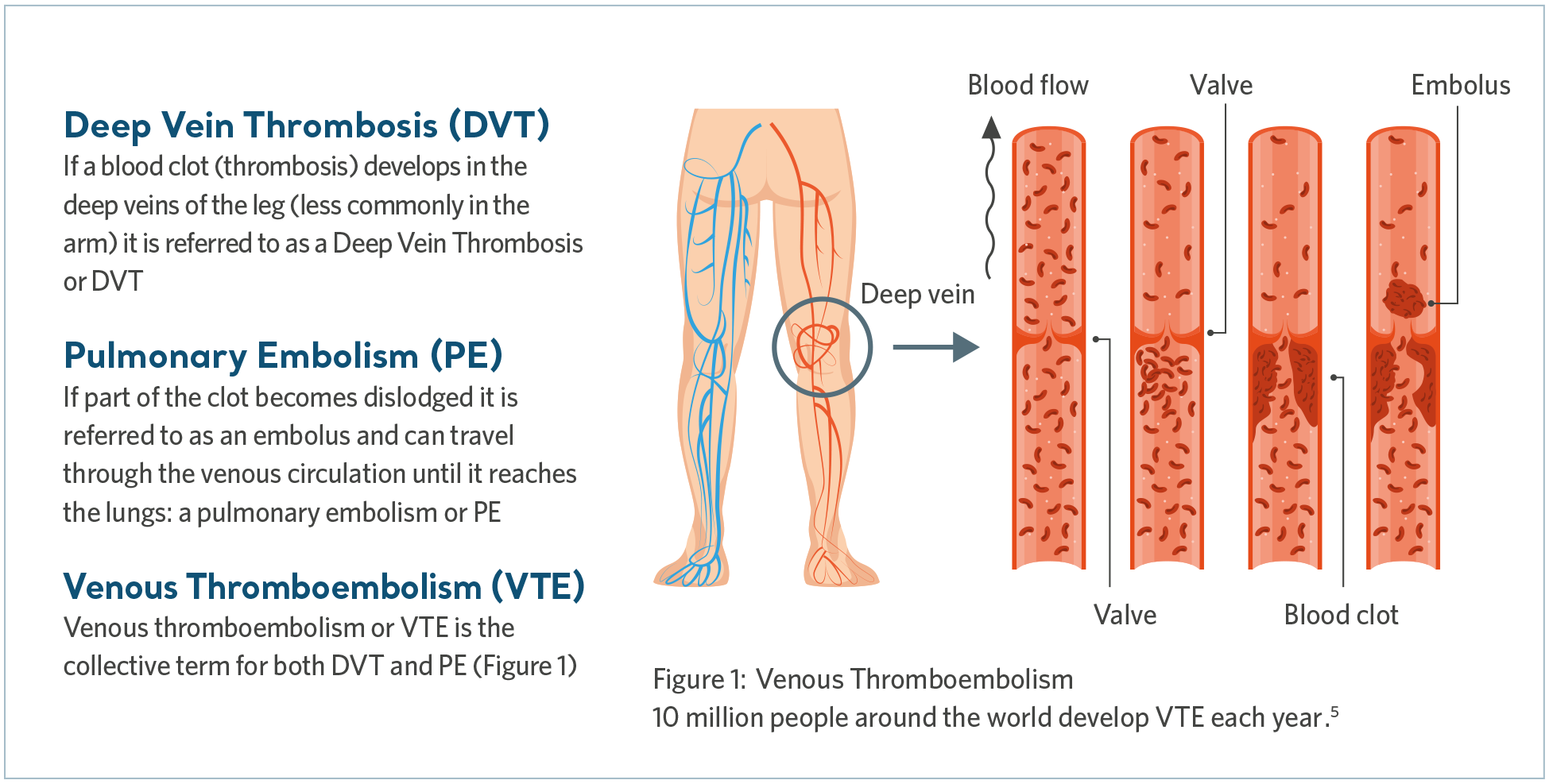
Was verursacht eine VTE?
VTE wird ausgelöst, wenn mehrere Risikofaktoren, die zusammen als „Virchow-Trias“ bezeichnet werden, das Gleichgewicht der Homöostase kippen, was zur Gerinnselbildung führt.6 Schauen wir uns einmal jedes Element an, das die Virchow-Trias ausmacht.
Virchow-Trias
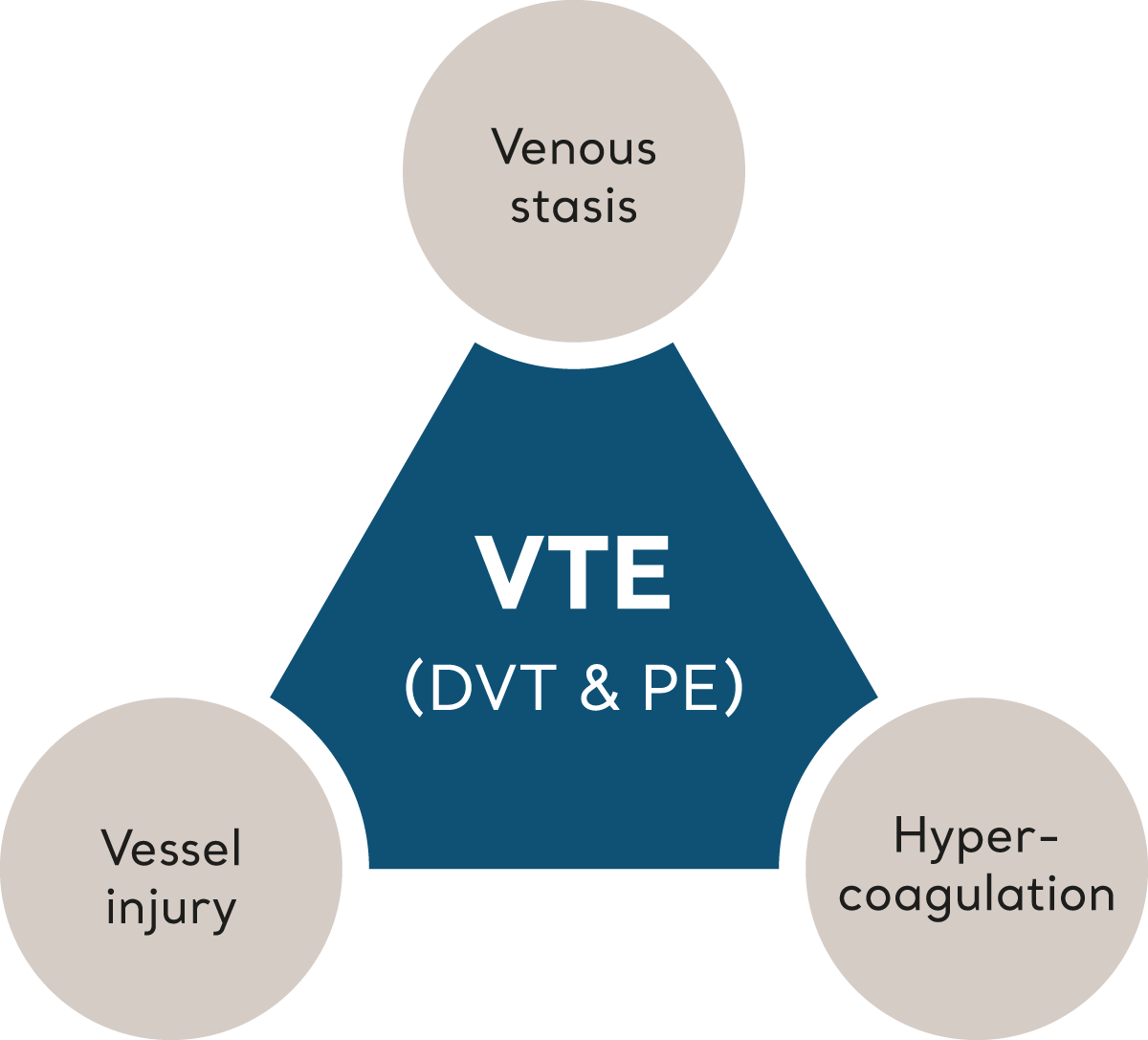
Venöse Stase
Umstände, die den Blutfluss in den tiefen Venen verlangsamen (Stase), erhöhen das VTE-Risiko. Immobilität, möglicherweise aufgrund von Alter, Gebrechlichkeit oder vorgeschriebener Bettruhe, ist ein eindeutiger Risikofaktor.
Physische Behinderungen der tiefen Gefäße, entweder durch äußere Kräfte oder durch Druck von Tumoren und Lymphknoten, werden ebenso als Risikofaktoren angesehen wie frühere TVTs.
Hyperkoagulation
Veränderungen in der Dichte und der Chemie des Blutes können die Gerinnungsneigung des Blutes erhöhen. Dies ist mit Bedingungen wie einfacher Dehydrierung bis hin zu Hypoxie, Malignität, Traumata, Hormontherapie, entzündlichen Systemerkrankungen und genetischer Veranlagung verbunden.
Gefäßverletzung
Verletzungen können durch unfallbedingte Traumata oder durch medizinische Eingriffe wie chirurgische oder invasive Maßnahmen entstehen. Sobald eine Verletzung auftritt, löst eine normale physiologische Reihe von Ereignissen eine Thrombozytenadhäsion und schließlich die Bildung eines Blutgerinnsels aus. Dieser Schutzmechanismus verschließt die Wunde und leitet den Heilungsprozess ein. Manchmal ist dieser Prozess jedoch unverhältnismäßig oder unangemessen.
Wer ist vom VTE-Risiko betroffen?
Stationäre chirurgische Patienten sind eine besondere Risikogruppe7, da die Operation selbst aufgrund der Anästhesie (Hyperkoagulabilität), der Muskelentspannungsmittel (Stase) und des chirurgischen Eingriffs
(Gefäßschädigung) den größten Risikoanstieg verursacht. Es steht ebenfalls fest, dass nicht-chirurgische Krankenhauspatienten einem hohen VTE-Risiko ausgesetzt sind.
Henrik Runnerström dazu: „Es gibt zahlreiche Faktoren, die zu VTE beitragen, und selbst wenn die Erkrankung oft mit immobilen und älteren Menschen in Verbindung gebracht wird, kann sie auch einen scheinbar gesunden, fitten und sportlichen Menschen treffen.“
Der ehemalige Spitzenhockeyspieler Stefan Elvenes aus Schweden ist ein Beispiel dafür. Einige Monate nach seinem Ausscheiden aus dem Eishockey – nach seiner 22-jährigen Karriere auf höchstem Niveau in Schweden und Dänemark – bemerkte er eine Schwellung auf der Rückseite seines linken Beins.
„Als mir der Arzt sagte, dass es sich um ein Blutgerinnsel handelte, konnte ich es nicht fassen. Ich war erst 37 Jahre alt und immer noch äußerst fit. So etwas sollte bei mir gar nicht erst vorkommen“, sagt Stefan.
Nachdem ihm mitgeteilt wurde, dass Blutgerinnsel auch bei jüngeren und sportlichen Menschen auftreten können, wurde Stefan erfolgreich mit Blutverdünnern behandelt. Drei Wochen, nachdem er seine Medikamente abgesetzt hatte, erlitt er jedoch eine schlimme Panikattacke.
„Mir ging ständig durch den Kopf, dass ich durch das Absetzen meiner Medikamente ein weiteres Blutgerinnsel riskierte. Das löste wahrscheinlich meine Panikattacken aus“, sagt Stefan. „Ich war lange Zeit ein geistiges Wrack. Aber die regelmäßige Therapie bei einem Psychologen half mir, meine Ängste zu überwinden. Heute bin ich damit im Reinen.“
Stefans Geschichte hier ansehen
Prävention von VTE
Eine pharmakologische Prophylaxe wie die Blutverdünner, mit denen Stefan behandelt wurde, ist eine Möglichkeit, mit VTE umzugehen. Zu den präventiven Maßnahmen gehören außerdem verschiedene mechanische Verfahren, wie die intermittierende pneumatische Kompression (IPK) sowie passive medizinische Thromboseprophylaxestrümpfe (MTS).
Die IPK ist eine sehr bewährte und erprobte Intervention mit einer überzeugenden Evidenzbasis und wenigen Nebenwirkungen – und ist darüber hinaus für den Einsatz bei einem breiten Spektrum von Krankenhauspatienten mit VTE-Risiko indiziert.
Der Zweck der IPK besteht darin, Blut durch das intermittierende Belüften und Entlüften einer Manschette, die an einen elektrischen Kompressor angeschlossen ist, aus den tieferen Venen zu treiben.
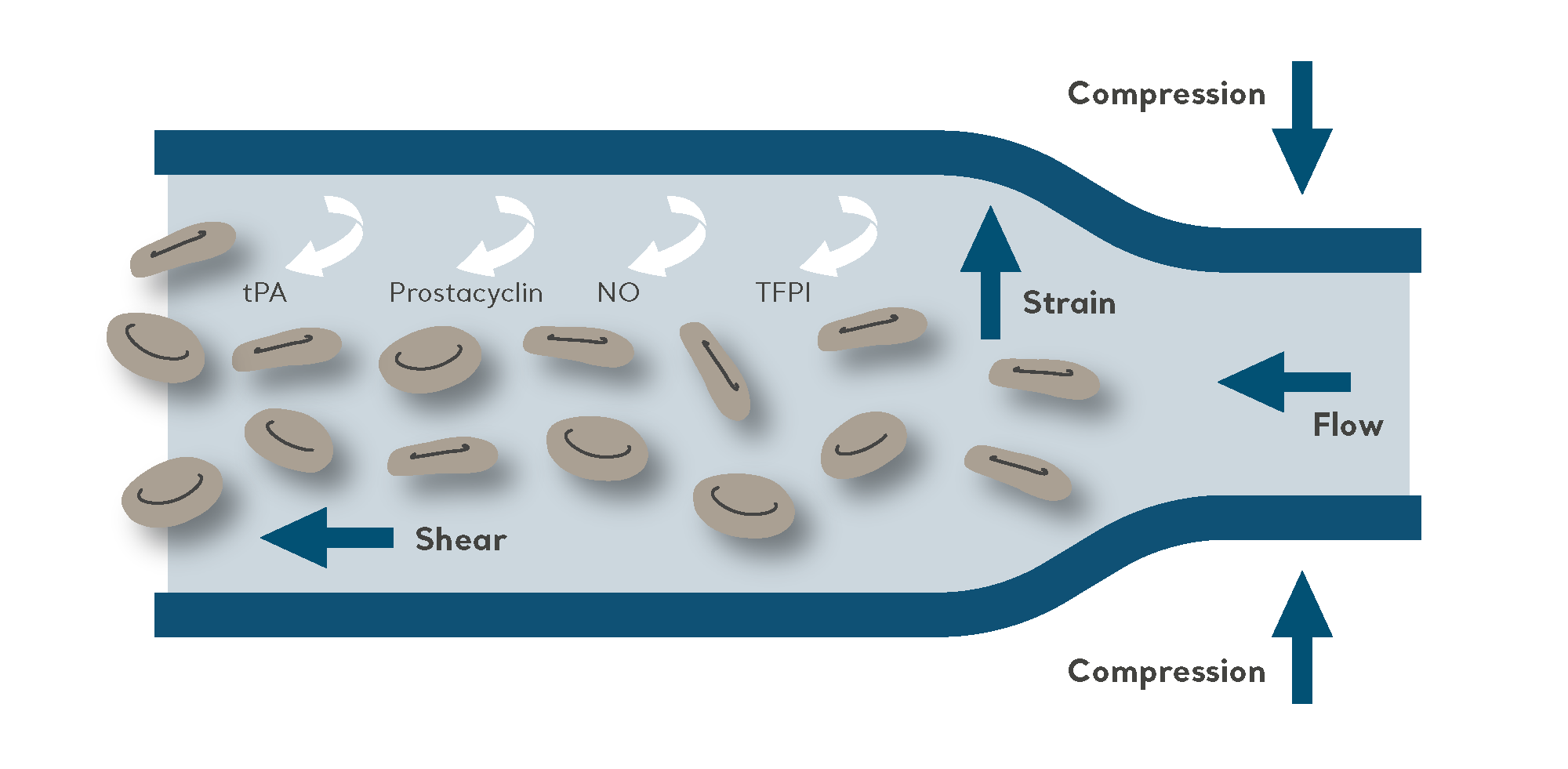
Als eine nicht-invasive mechanische Methode der VTE-Prophylaxe ist die IPK wirksam, wenn sie als alleinige Präventionsmethode u. a. bei Patienten mit hohem Blutungsrisiko eingesetzt wird. Sie wird außerdem sehr häufig in Kombination mit pharmakologischer Prophylaxe für Hochrisikopatienten verwendet (um das VTE-Risiko weiter zu reduzieren).
Ein vertrauenswürdiger Partner für den Einsatz von IPK im Bereich VTE-Prophylaxe
Seit den 1970er Jahren zeigten VTE-Studien deutlich den schützenden Nutzen der IPK für die tiefen Beinvenen. Seither ist Arjo maßgeblich an der Entwicklung einfach zu bedienender, klinisch wirksamer IPK-Systeme beteiligt, um Einrichtungen auf der ganzen Welt zu unterstützen. Die Flowtron-Reihe zur aktiven Kompression (Active Compression System, ACS) wurde entwickelt, um klinische Wirksamkeit durch Komfort, Benutzerfreundlichkeit und Kosteneffizienz zu erreichen.
Arjo setzt sich auch für die Verbesserung der Pflegequalität von Patienten ein und unterstützt Gesundheitsdienstleister bei der Bekämpfung von tiefer Venenthrombose und Lungenembolie.
„Unser Engagement geht über die Lieferung von Kompressoren und Manschetten hinaus, die in unserem Aktiven Kompressionssystem Flowtron enthalten sind. Wir möchten Arjo von der Konkurrenz abheben, indem wir als Partner unser Angebot um Dienstleistungen und wertvolles Wissen erweitern“, so Henrik Runnerström.
Und er ergänzt: „Auch wenn sich die Gesundheitsdienstleister der Risiken bewusst sind, fehlt es ihnen möglicherweise an Zeit, Ausbildung und Ressourcen, die erforderlich sind, um ihre Präventionsstrategien zu optimieren. Das Verständnis dieser Probleme ist die Grundlage für die Entwicklung unserer Dienstleistungen und Schulungsprogramme, die darauf abzielen, die Fähigkeit zur Prävention und Behandlung von VTE zu verbessern."
Das Aktive Kompressionssystem Flowtron – eine echte Plug-and-Play-Lösung
Bei der Lösung von Arjo, dem Aktiven Kompressionssystem Flowtron, dient ein pneumatischer Kompressor dazu, Manschetten um den Fuß, die Wade, den Oberschenkel oder kombiniert in diesen drei Bereichen zu belüften.
Dazu sagt Henrik Runnerström: „Durch die Nachahmung der Wirkung der Wadenmuskelpumpe erhöht die IPK die Blutzirkulation in den tiefen Venen und verhindert die Gerinnung des Blutes. Sie ist eine bewährte und erprobte Therapie mit einer überzeugenden Evidenzbasis.“

Der Flowtron ACS900 Kompressor (siehe Abb. oben) bietet sowohl eine gleichmäßige als auch eine sequentielle Kompression über eine Vielzahl von Manschettentypen. Die automatische Manschettenerkennung SmartSenseTM (siehe Abb. unten) macht Flowtron zusammen mit dem Start per Knopfdruck zu einer echten Plug-and-Play-Lösung.
„Die Flexibilität reduziert den Bedarf an mehreren Kompressormodellen in der Versorgungseinrichtung“, sagt Henrik Runnerström. „Das System ist einfach einzurichten und zu bedienen, und der integrierte Akku ermöglicht eine unterbrechungsfreie Therapie, auch wenn der Kompressor nicht an eine Steckdose angeschlossen ist.“
Und er ergänzt: „In Verbindung mit unserem Sortiment an Manschetten ist das System bequem für den Patienten, komfortabel für das medizinische Fachpersonal und klinisch wirksam bei der Anwendung einer intermittierenden pneumatischen Kompression – und trägt so zu einer besseren Compliance für alle in die Patientenversorgung involvierten Personen bei.“
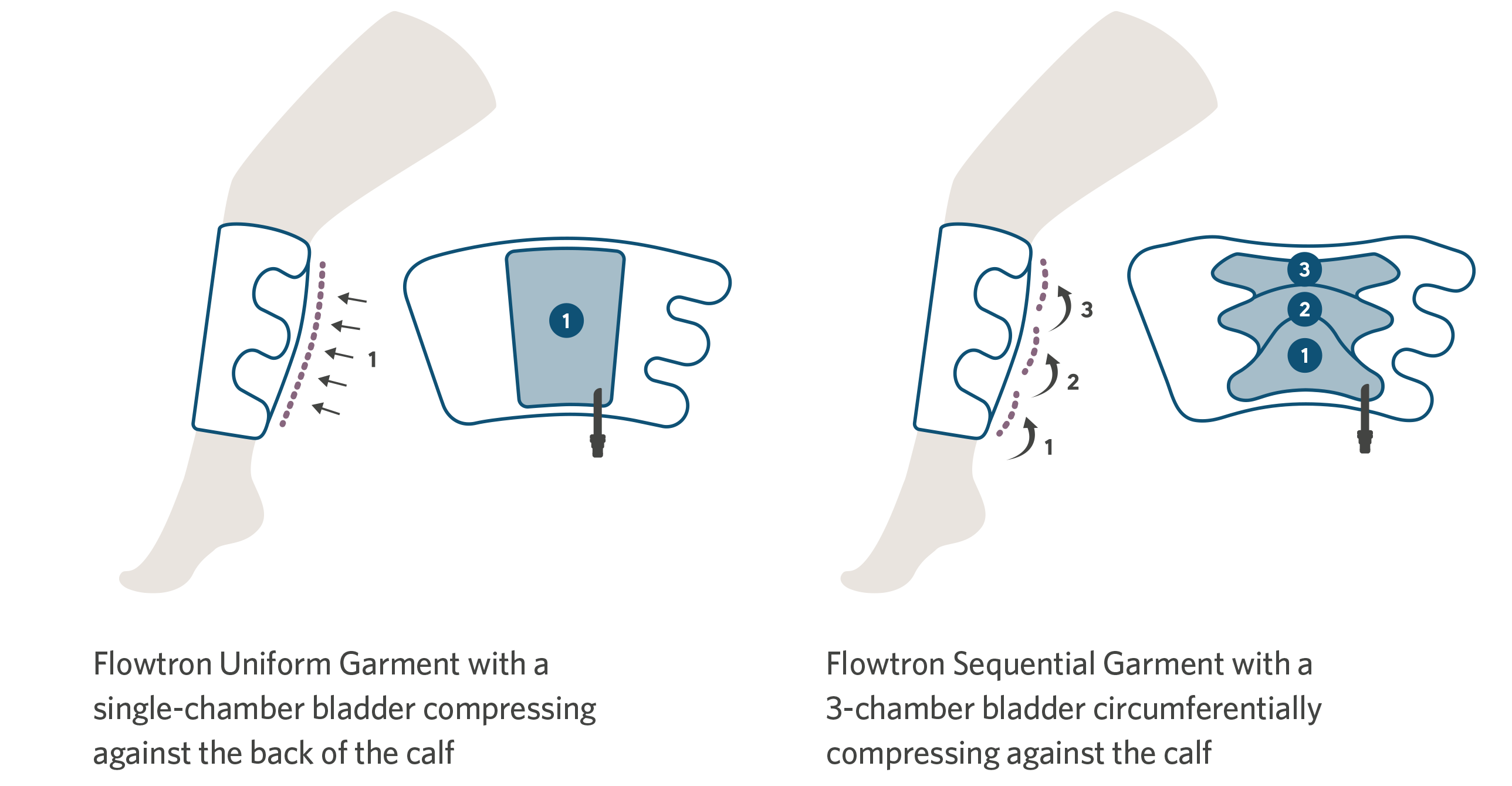
Für den Komfort gibt es eine Auswahl an waden- oder oberschenkellangen Flowtron-Manschetten, die entweder eine sequentielle oder eine gleichmäßige Kompression bieten und in verschiedenen Größen für kleine bis bariatrische Patienten erhältlich sind. Die Fußkompression ist in normaler oder großer Fußgröße erhältlich. Eine Kombination verschiedener Manschetten kann gleichzeitig verwendet werden. Die Wahl der Manschette hängt einfach von der Präferenz des Arztes ab.
Henrik Runnerström erläutert: „Internationale Richtlinien empfehlen eine kontinuierliche Therapie von 18–24 Stunden pro Tag.8 Studien zeigen einen direkten Zusammenhang zwischen dem Komfortniveau und der Bereitschaft der Patienten, die Manschetten über einen längeren Zeitraum zu tragen.9 Unser Ziel ist es, den Patientenkomfort zu verbessern, indem wir atmungsaktive Materialien verwenden, die dazu beitragen, den Patienten trocken und kühl zu halten, indem sie Wärme und Feuchtigkeit durchlassen.“
Erfahren Sie hier mehr über das Aktive Kompressionssystem Flowtron
Flowtron IPK – klinische Daten
Laborstudien
Viele der früheren Studien, die die intermittierende pneumatische Kompression als generische Form der VTE-Prophylaxe untermauern, wurden mit Vorgängermodellen der heutigen Flowtron-Reihe durchgeführt. Obwohl die Technologie weiterentwickelt wurde, bleiben die zugrunde liegenden Gestaltungsprinzipien wie Zyklusdruck, Belüftungsrate und Zyklusintervalle unverändert.
In den Studien, die die antithrombotische und profibrinolytische Wirkung von IPK zeigen, deuten wichtige Erkenntnisse darauf hin, dass die IPK die Bildung von Gerinnseln weniger wahrscheinlich macht. Darüber hinaus wirkt die IPK ebenfalls verstärkt gegen die Gerinnselbildung und löst Gerinnsel auf, sobald sie sich bilden.7
Die wichtigsten Ergebnisse dieser Studien besagten, dass sich durch die IPK vermutlich weniger Blutgerinnsel bilden und dass sie außerdem verstärkt gegen die Gerinnselbildung wirkt sowie Gerinnsel auflöst, sobald sie sich bilden.
Vergleichende Studien zur Durchblutung
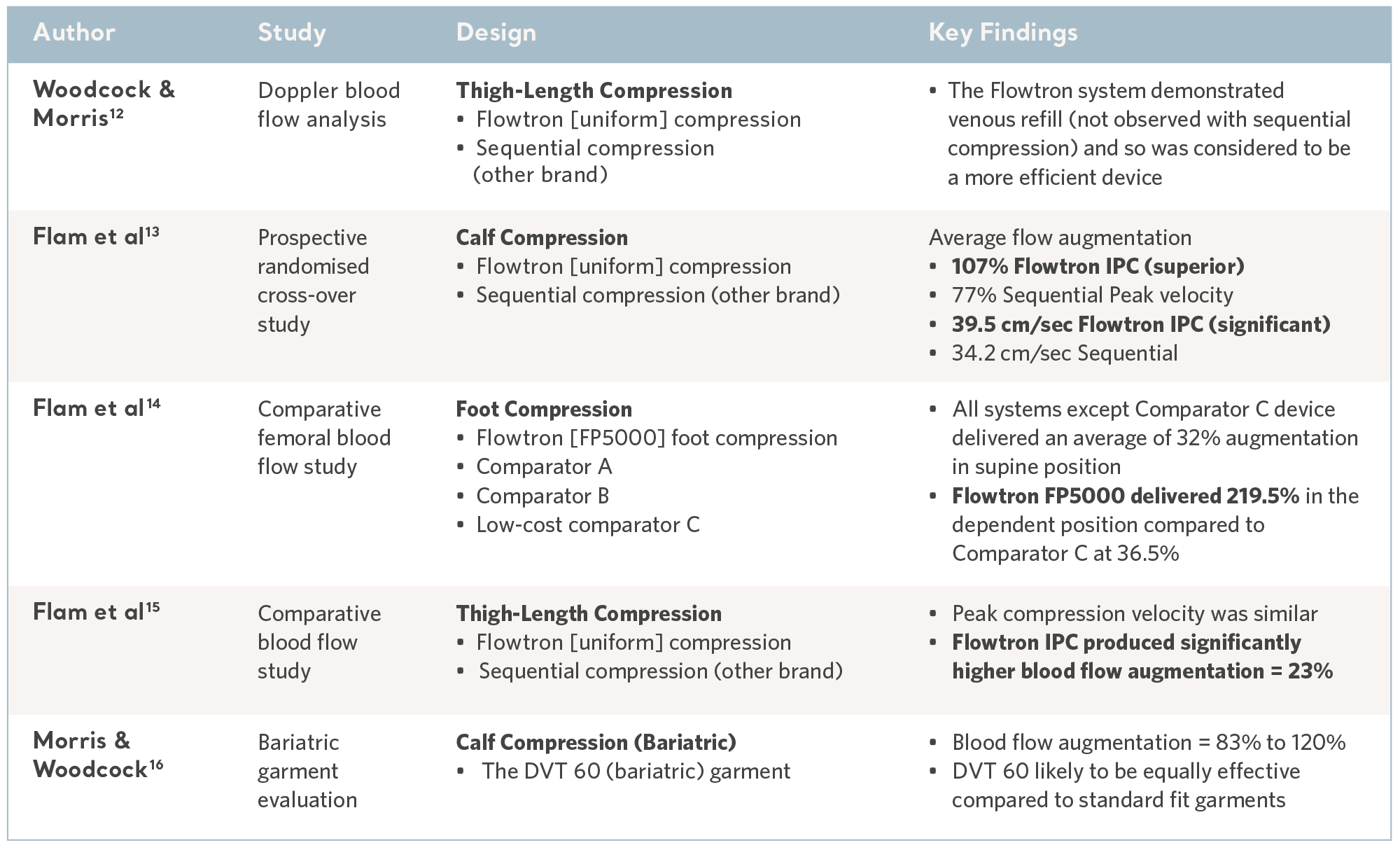
Die Umkehrung der venösen Stase ist der Schlüssel zur Prävention und die Flowtron IPK-Reihe wurde einer Reihe von vergleichenden Labortests unterzogen, die stets positive Ergebnisse zeigten.10,11 Siehe Tabelle unten.
Labornachweise
Klinische Wirksamkeit
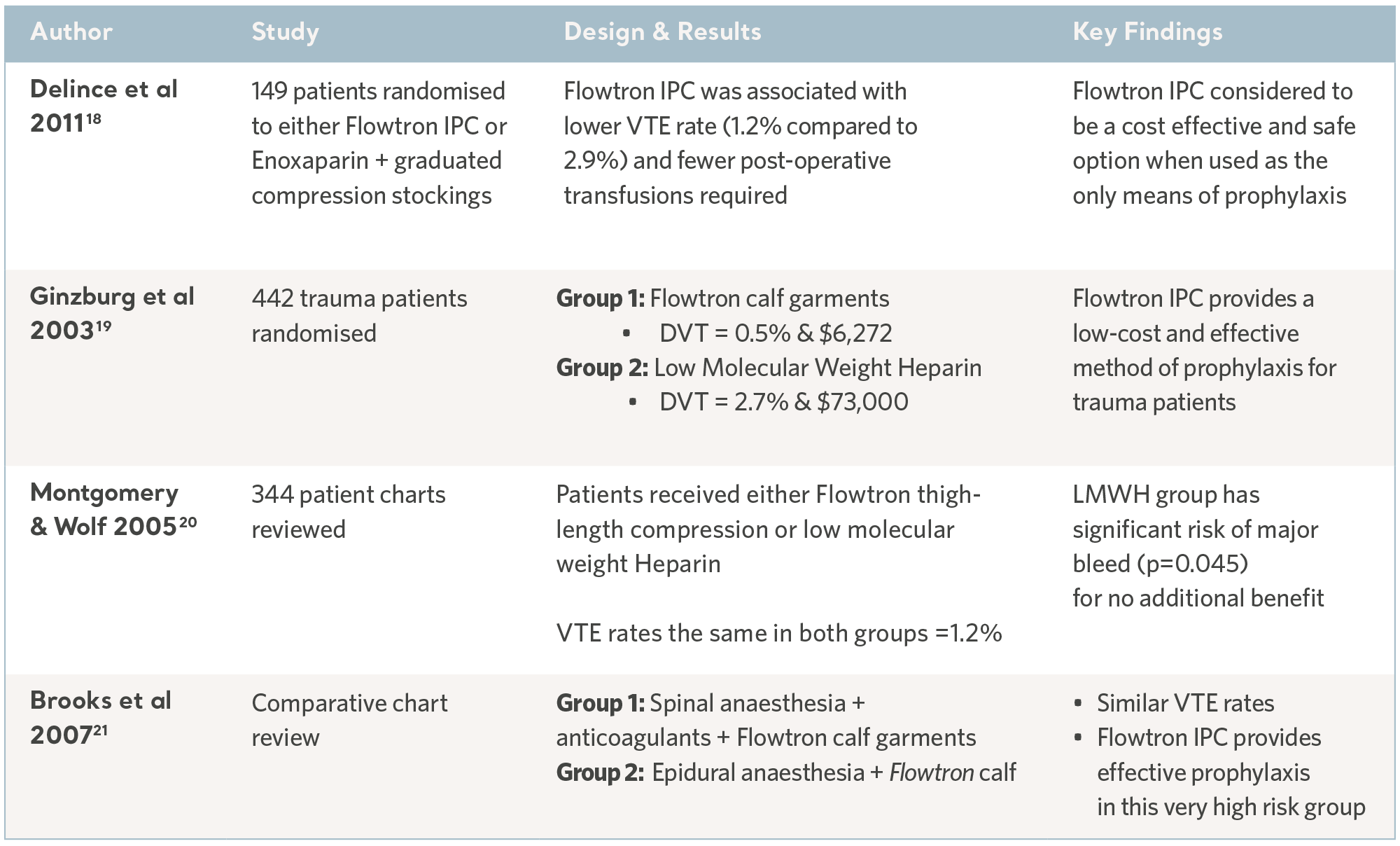
In den letzten 30 Jahren haben unabhängige Spezialisten eine Reihe von klinischen Studien durchgeführt. Die Teilnehmer wurden aus Patientengruppen mit dem höchsten Risiko und aus einer Reihe von klinischen Fachgebieten ausgewählt. Die Ergebnisse haben die prophylaktische Leistungsfähigkeit der Flowtron IPK-Reihe bei der Verwendung mit oder anstelle anderer Prophylaxemethoden durchgängig nachgewiesen. Obwohl die IPK mittlerweile als eine zulässige Form der Prophylaxe weithin anerkannt ist, haben diese Studien weiterhin einen hohen Stellenwert.17 Siehe nachstehende Tabellen.
Flowtron klinische Ergebnisstudien
Flowtron-Nachweis in Fachgruppen
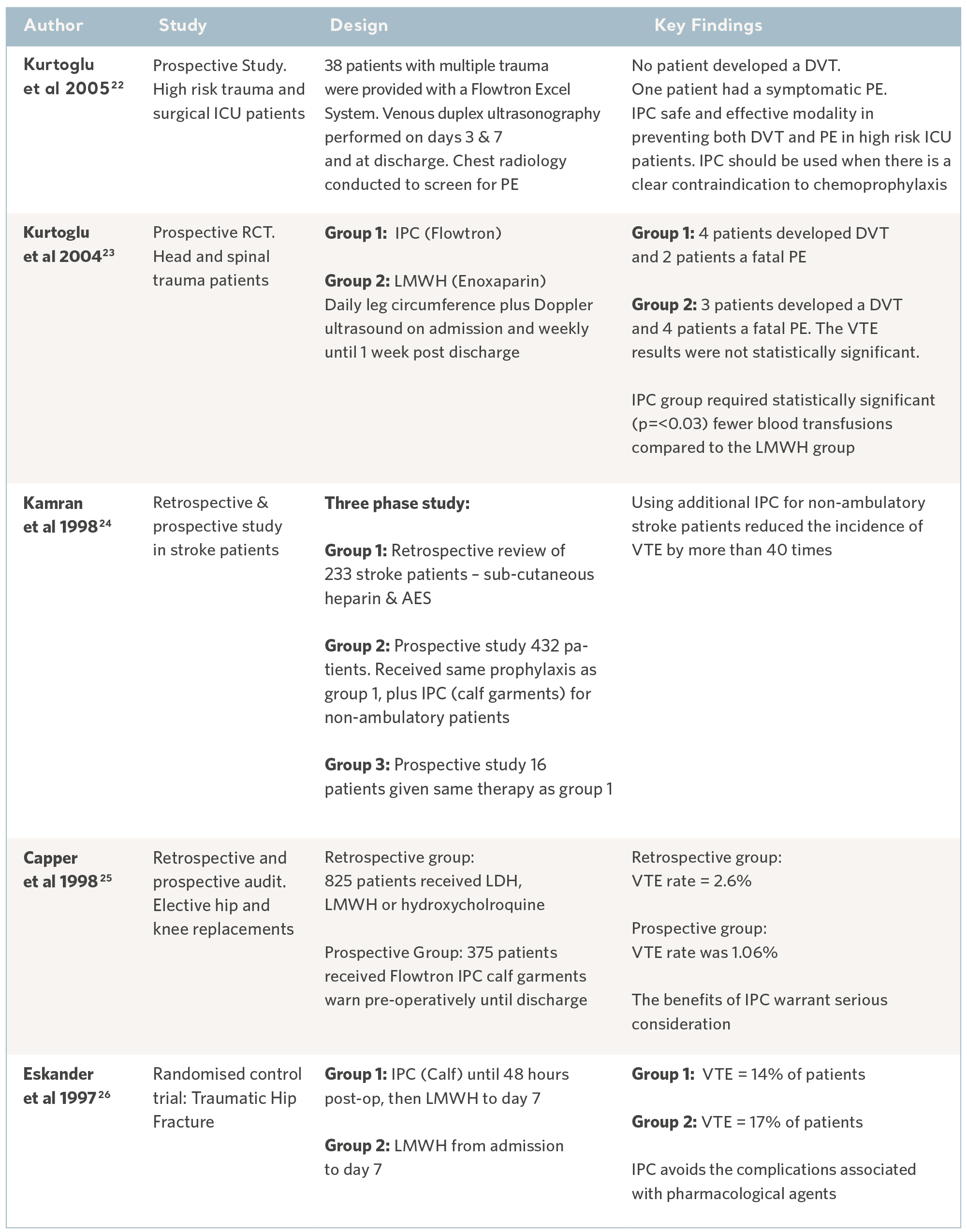
IPK-Nachweis aus Meta-Analysen und systematischen Untersuchungen
Wie bei allen präventiven Eingriffen kann die IPK nur dann wirksam sein, wenn sie beim richtigen Patienten zum richtigen Zeitpunkt eingesetzt wird, und das bedeutet, dass Risikopatienten vor einem VTE-Ereignis identifiziert werden.
Gleichzeitig muss das Risiko von Nebenwirkungen berücksichtigt werden, insbesondere das Risiko von Blutungen im Zusammenhang mit der Anwendung von Antikoagulation.
Meta-Analysen und systematische Untersuchungen, bei denen mehrere Nachweisquellen kombiniert werden, um den gesamten klinischen Nutzen von der IPK zu bestimmen, sind nützliche Informationsquellen und können zur Verschreibung führen.
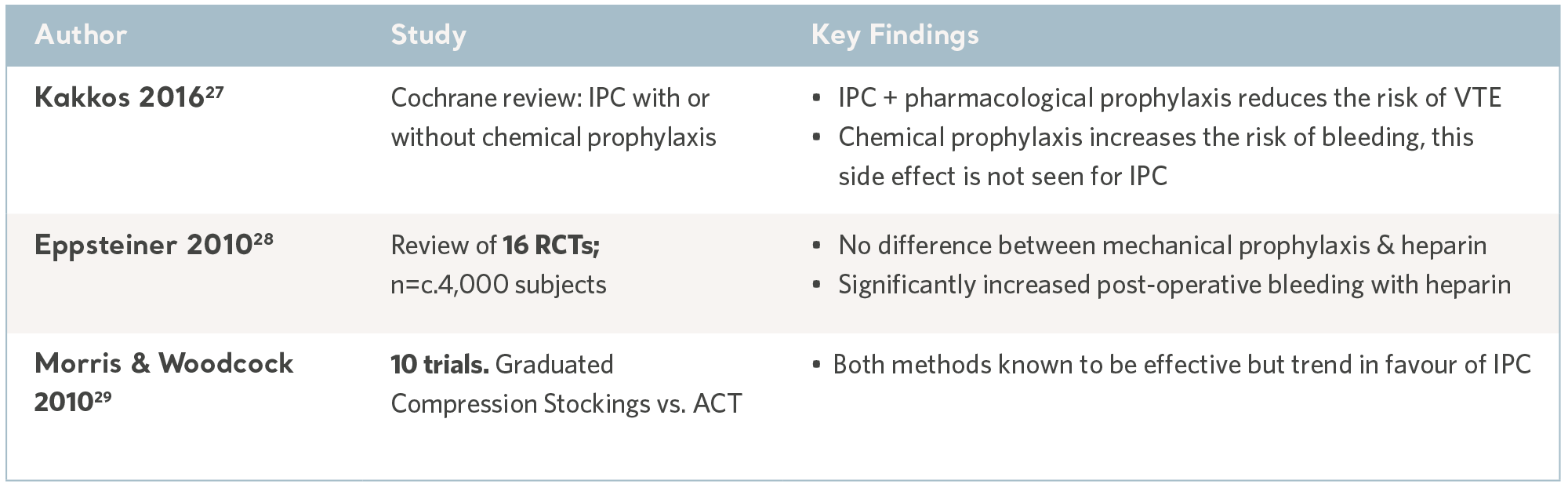
Als Erweiterung der systematischen Untersuchung wird durch die Veröffentlichung von nationalen und internationalen Leitlinien für die klinische Praxis solide und zeitgemäße Forschung in diskrete Empfehlungen umgesetzt. Wissenslücken werden durch internationale Konsensgremien aufgefüllt. Obwohl der Wortlaut variiert, sind die Empfehlungen weitgehend konsistent und alle erkennen die IPK als wirksame und sichere Intervention an. Siehe Tabelle unten.
IPK-Nachweis aus systematischen Untersuchungen
Komfort
Wie bei jeder Methode der Prophylaxe ist die IPK nur dann von Vorteil, wenn sie von den Patienten, die sie anwenden, richtig angewendet und vertragen wird. Komfort und Benutzerfreundlichkeit stehen im Vordergrund und die Konkordanz kann variieren.30
In einem geschäftigen klinischen Umfeld kann sich das Gerät aufgrund einer intuitiven Benutzeroberfläche und entsprechenden Sicherheitsfunktionen als Vorteil erweisen, um das Risiko von Verletzungen zu minimieren. Einige dieser Aspekte wurden in Brauchbarkeitsstudien und durch unabhängige Technologiebewertungen evaluiert, die neben der Wirtschaftlichkeit auch Sicherheit, Qualität und Benutzerfreundlichkeit bewerteten. Siehe Tabelle unten.
Nachweis aus Brauchbarkeitsstudien 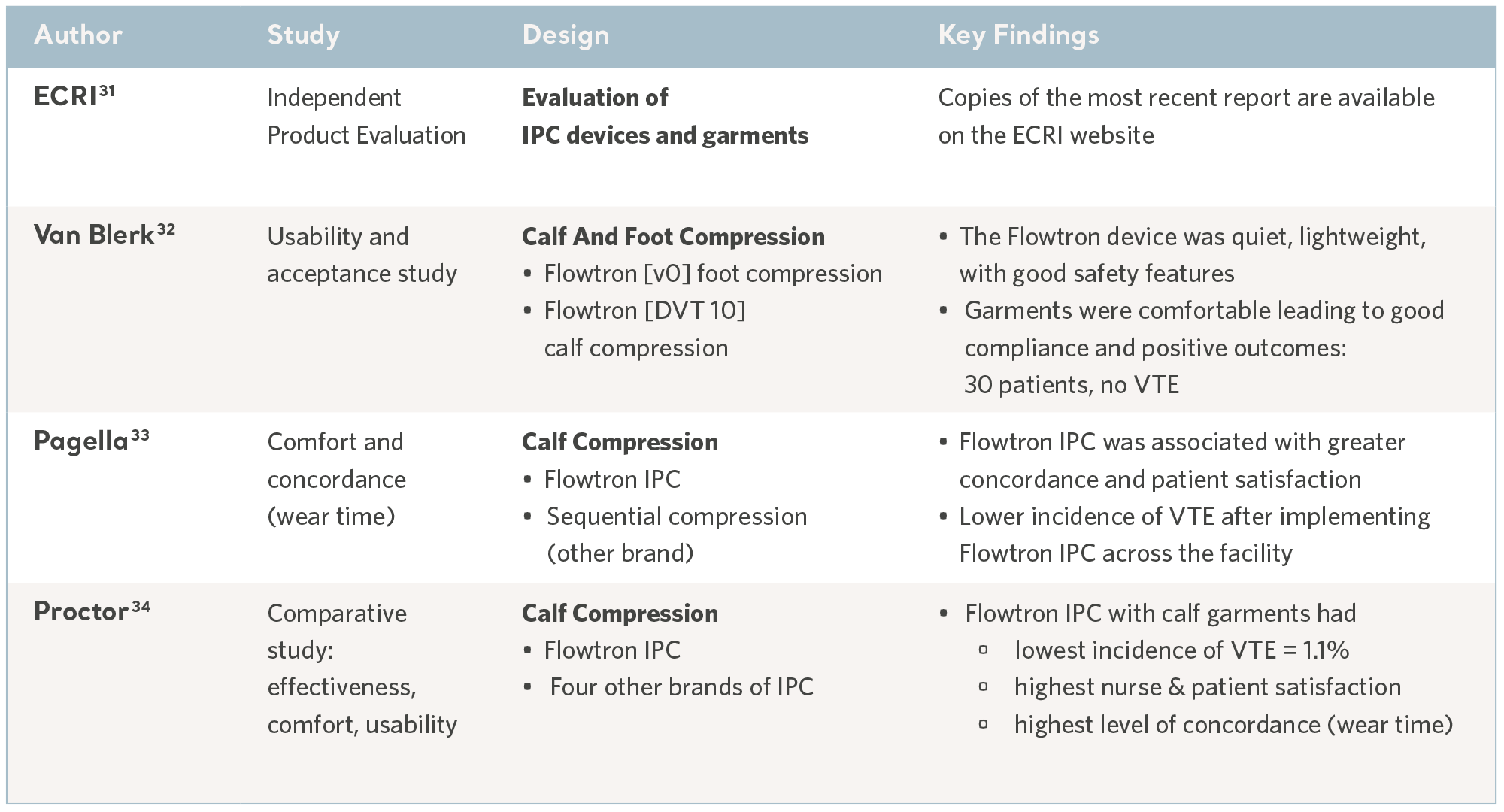
Erfahren Sie mehr über klinische Daten zur Flowtron IPK
Quellenangaben
1 – Beckman MG, Hooper WC, Critchley SE et al. Venous thromboembolism: a public health concern. Am J Prev Med. 2010; 38(4): S495-501.
2 – Nelzen O, Bergqvist D, Lindhagen A. Leg ulcer etiology - a cross sectional population study. J Vasc Surg. 1991; 14: 557-64 cited in Nicolaides A, Fareed J, Kakkar A et al. Prevention and treatment of venous thromboembolism - International Consensus Statement. International Angiology. 2013; 32(2): 111-260.
3 – Ruppert A, Steinle T, Lees M. Economic burden of venous thromboembolism: a systematic review. J Med Econ. 2011; 14(1): 65-74
4 – Prevention and treatment of venous thromboembolism. Heart.org. https://www.heart.org/en/health-topics/venous-thromboembolism/prevention-andtreatmentof-venous-thromboembolism-vte. Letzter Zugriff im Dezember 2019.
5 – Jha AK, Larizgoitia I, Audera-Lopez C et al. The global burden of unsafe medical care: analytic modelling of observational studies. BMJ Qual Saf 2013; 22: 809-15.
6 – Reitsma PH, Versteeg HH, Middeldorp S. Mechanistic view of risk factors for venous thromboembolism. Arteriosclerosis, thrombosis and vascular biology. 2012; 32(3): 563-8.
7 – Nicolaides A, Fareed J, Kakkar A et al. Prevention and treatment of venous thromboembolism - International Consensus Statement. International Angiology. 2013;32(2): 111-260.
8 – Guyatt GH, AKL EA, Crowther M et al. Executive Summary: Antithrombotic Therapy and Prevention of Thrombosis. 9th edition. American College of Chest Physicians. Evidence-Based Clinical Practice Guidelines. Chest. 2012; 141(2):7S-47S.
9 – Pagella P, Cipolle M, Sacco E et al. A randomised trial to evaluate compliance in terms of patient comfort and satisfaction of two pneumatic compression devices. Orthop Nurs. 2007; 26(3):169-74.
10 – Morris RJ, Giddings JC, Ralis HM, et aL. Haematological and haemodynamic comparison of the Kendall AV Impulse™ and the Arjo [Huntleigh] FP5000 Intermittent Pneumatic Foot Compression System. Arjo Clinical Report 2003.
11 – Westrich G, Specht LM, Sharrock NE et al. Venous haemodynamics after total knee arthroplasty: evaluation of active dorsal to plantar flexion and several mechanical compression devices. The Journal of Bone & Joint Surgery. 1998; 80B(6): 1057-1066.
12 – WoodcockJPandMorrisRJ.TheeffectoftheKendallSCDTMandArjo[Huntleigh]DVT30 garments on femoral and popliteal vein blood flow measurements. Arjo Clinical Report. 2002.
13 – Flam E, Berry S, Coyle A et al. Blood flow augmentation of intermittent pneumatic compression systems used for the prevention of deep vein thrombosis prior to surgery. The American Journal of Surgery. 1996; 171(3): 312-315.
14 – Flam E, Nackman G, Tarantino D et al. Intermittent pneumatic compression devices of the foot: a comparison of various systems on femoral vein blood flow velocity augmentation in the v supine and dependent, non-weight bearing positions. Arjo Clinical Report 2000.
15 – Flam E, Berry S, Coyle A et al. DVT prophylaxis: comparison of two thigh high intermittent pneumatic compression systems. Presented at the meeting of the American College of Surgeons, San Francisco. 1993.
16 – Morris RJ and Woodcock JP. Intermittent pneumatic compression for bariatric patients – the DVT60 compression garment. Arjo Clinical Report 2003.
17 – Falck-Ytter Y, Francis CW, Johanson NA et al. Antithrombotic Therapy and Prevention of Thrombosis, 9th edition: ACCP Evidence Based Clinical Practice Guidelines: Prevention of VTE in Orthopedic Surgery Patients. Chest. 2012; 141: S2.
18 – Delince P. RCT of intermittent pneumatic compression (IPC) versus low molecular weight heparin (LMWH) plus anti-embolic stockings (AES) in the prevention of venous thromboembolism during elective hip and knee surgery. Am. Ass. Orth. Surg. Conference 2011.
19 – Ginzburg E, Cohn S, Lopez J et al. Randomised clinical trial of intermittent pneumatic compression and low molecular weight heparin in trauma. British Journal of Surgery. 2003; 90: 1338-1344.
20 – Montgomery JS and Wolf JS (2005). Venous Thrombosis Prophylaxis for Urological Laparoscopy: Fractionated Heparin versus Sequential Compression Devices. The Journal of Urology. 2005; 173: 1623-1626.
21 – Brooks PJ, Keramati M, Wickline A . Thromboembolism in patients undergoing total knee arthroplasty with epidural analgesia. Journal of Arthroplasty. 2007; 22(5): 641-643.
22 – Kurtoglu M, Guloglu R, Ertekin C et al. Intermittent pneumatic compression in the prevention of venous thromboembolism in high-risk trauma and surgical ICU patients. Turkish Journal of Trauma & Emergency Surgery. 2005; 11(1): 38-42.
23 – Kurtoglu M, Yanar H et al. Venous thromboembolism prophylaxis after head and
spinal trauma: Intermittent pneumatic compression devices versus low molecular weight heparin. World Journal of Surgery. 2004; 28(8): 807-811.
24 – Kamran SI, Downey D and Ruff RL. Pneumatic sequential compression reduces the risk of deep vein thrombosis in stroke patients. Neurology. 1998; 50(6): 1683-1688.
25 – Capper C. External pneumatic compression therapy for DVT prophylaxis. British Journal of Nursing. 1998; 7(14): 851-854.
26 – Eskander M, Limb D, Stone M et al. Sequential mechanical and pharmacological thrombo prophylaxis in the surgery of hip fractures. International Orthopaedics. 1997; 21: 259-261.
27 – KakkosSK, Caprini JA, Geroulakos G, et al.Combined intermittent pneumatic leg compression and pharmacological prophylaxis for prevention of venous thromboembolism. Cochrane Database of Systematic Reviews. Wiley & Sonds. 2016; 9. www.cochranelibrary.com
28 – Eppsteiner RW, Shin JJ, Johnson J, van Dam RM. Mechanical compression versus heparin therapy in postoperative and post trauma patients: a systematic review and meta-analysis. World Journal of Surgery. 2010; 34(1): 10-19.
29 – Morris RJ, Woodcock JP. Intermittent pneumatic compression or graduated compression stockings for deep vein thrombosis prophylaxis? A systematic review of direct clinical comparisons. Annals of Surgery. 2010; 251(3): 393-6.
30 – Elpern E, Killeen K, Patel G, Senecal PA. Original Research: The Application of Intermittent Pneumatic Compression Devices for Thromboprophylaxis. AJN The American Journal of Nursing. 2013 Apr 1;113(4):30-6
31 – ECRI Institute. March 2017 https://www.ecri.org/Pages/default.aspx
32 – Van Blerk D. Evaluating an Intermittent Compression System for Thromboembolism Prophylaxis. Professional Nurse. 2004; 20(4): 48-49.
33 – Pagella P, Cipolle M, Sacco E et al. A randomised trial to evaluate compliance in terms of patient comfort and satisfaction of two pneumatic compression devices.
Orthopaedic Nursing. 2007; 26(3): 169-174.
34 – Proctor MC, Greenfield LJ, Wakefield TW et al. A clinical comparison of pneumatic compression devices: the basis for selection. Journal of Vascular Surgery. 2001; 34(3): 459-464.